1. 方法原理
在(zai)硫(liu)酸(suan)溶液中(zhong),六價鉻被(bei)亞鐵離子還原為三價鉻:
2H2CrO4+6H2SO4+6FeSO4 = Cr2(SO4)3+3Fe2(SO4)3+8H2O
以苯(ben)基代鄰氨基苯(ben)甲酸(PA酸)為指示劑指示反應終點。
三價(jia)鉻在酸(suan)(suan)性溶液中(zhong),在硝酸(suan)(suan)銀催化(hua)下,以過硫(liu)酸(suan)(suan)銨(an)氧化(hua)成六(liu)價(jia)銘,得到總鉻量。
Cr2(SO4)3+3(NH4)2S2O8+8H2O=-2H2CrO4+3(NH4)2SO4+6H2SO4
然后測(ce)定(ding)總鉻(ge)量消(xiao)耗的(de)(de)亞鐵(tie)量減去六價(jia)鉻(ge)消(xiao)耗的(de)(de)亞鐵(tie)量,即(ji)得三價(jia)鉻(ge)量。
硝(xiao)(xiao)酸(suan)銀(yin)(yin)對氧化(hua)反應起催化(hua)作(zuo)用,銀(yin)(yin)離子和過硫酸(suan)銨(an)生成(cheng)(cheng)過硫酸(suan)銀(yin)(yin),過硫酸(suan)銀(yin)(yin)能將(jiang)三(san)價鉻氧化(hua)成(cheng)(cheng)六(liu)價鉻。氧化(hua)反應完成(cheng)(cheng)后,硝(xiao)(xiao)酸(suan)銀(yin)(yin)仍恢復(fu)原來的(de)狀態。過量的(de)過硫酸(suan)銨(an)對測(ce)定有干擾作(zuo)用,必須經煮沸后完全分(fen)解出(chu)氧氣。分(fen)解反應如下:
2(NH4)2S2O8+2H2O = 2(NH4)2SO4+2H2SO4+O2↑
2. 試劑(ji)
①. 硫酸
1+1,即1體積分量的硫酸(suan)加(jia)入1體積分量的水中。
②. 苯基(ji)(ji)代鄰(lin)氨基(ji)(ji)苯甲酸(PA酸)指示劑
0.27g PA酸溶于(yu)5mL的(de)5%碳酸鈉溶液(ye)中,以水稀(xi)釋至250mL.
③. 標準0.1mol硫(liu)酸亞鐵(tie)銨溶(rong)液
配制:稱取分析純硫酸亞鐵銨40g[FeSO4·(NH4)SO4·6H2O]溶于冷的5+95硫酸(5體積分量的硫酸溶于95體積分量的水中)500mL中,溶解完畢后以5+95硫酸稀釋至1L.亞鐵溶液在空氣中易氧化,應加入純鋁片若干,以還原被氧化的高鐵。應于使用前定期標定。鋁片的存在,有效維持亞鐵離子濃度的穩定(1個月左右)。同時投入少量NaHCO3,產生的CO2氣體隔絕空氣的氧化。
標(biao)(biao)定:以重鉻酸(suan)(suan)鉀(jia)標(biao)(biao)定。用移液(ye)管(guan)吸(xi)取(qu)標(biao)(biao)準(zhun)0.1mol重鉻酸(suan)(suan)鉀(jia)溶液(ye)(配(pei)制:取(qu)分(fen)析純重鉻酸(suan)(suan)鉀(jia)于(yu)150℃干(gan)(gan)燥1h,在(zai)干(gan)(gan)燥器(qi)內冷卻,準(zhun)確稱(cheng)取(qu)29.421g,溶解(jie)于(yu)水(shui),在(zai)量瓶(ping)中稀釋至(zhi)1L.不(bu)需標(biao)(biao)定)10mL于(yu)250mL錐(zhui)形瓶(ping)中,加水(shui)70mL及1+1 硫(liu)酸(suan)(suan)10mL,磷酸(suan)(suan)1mL.加入PA酸(suan)(suan)指示劑4滴(di),溶液(ye)呈紫紅色,用配(pei)制好的(de)(de)0.1mol 硫(liu)酸(suan)(suan)亞(ya)鐵(tie)銨(an)溶液(ye)滴(di)定至(zhi)紫紅色轉綠(lv)色為終點,記錄(lu)耗用的(de)(de)硫(liu)酸(suan)(suan)亞(ya)鐵(tie)銨(an)的(de)(de)體積V(mL)。(終點前應逐(zhu)滴(di)觀察。)
計算:標準硫酸亞鐵(tie)銨溶(rong)液的摩爾(er)濃(nong)度
M= 10×0.1×6 / V(mol/L)
④. 1%硝(xiao)酸銀(yin)溶(rong)(rong)液(ye)。稱取1g重的硝(xiao)酸銀(yin)溶(rong)(rong)解(jie)于(yu)100mL水中。或用0.1mol/L硝(xiao)酸銀(yin)標準溶(rong)(rong)液(ye)。
⑤. 過硫(liu)酸銨(an)。固體。
3. 分析(xi)方(fang)法
①. 吸取電解液各(ge)5mL于(yu)A、B兩個(ge)250mL錐形(xing)瓶(ping)中,各(ge)加水50mL(A、B各(ge)用于(yu)測定(ding)鉻(ge)酐和三價鉻(ge)之用)。
②. 各加1+1硫酸(suan)10mL.
③. 于B瓶中加硝酸銀10mL.
④. 于B瓶中加過(guo)硫(liu)酸(suan)銨2g,煮沸至冒大(da)氣泡2min左右(you),冷卻。
⑤. 向A、B兩瓶中加PA酸5滴(di),搖(yao)勻(yun)。
⑥. 用(yong)標(biao)準0.1mol硫(liu)酸(suan)亞(ya)鐵(tie)銨溶液滴(di)定A、B兩瓶各至由紫紅色(se)變綠色(se)為(wei)(wei)終(zhong)點,記錄(lu)分析(xi)A、B各耗(hao)(hao)用(yong)標(biao)準硫(liu)酸(suan)亞(ya)鐵(tie)銨溶液各為(wei)(wei)V1和(he)V2的(de)(de)體(ti)積(mL)。V1為(wei)(wei)分析(xi)鉻酐(gan)時耗(hao)(hao)用(yong)硫(liu)酸(suan)亞(ya)鐵(tie)銨溶液的(de)(de)體(ti)積(mL),V2為(wei)(wei)分析(xi)總鉻酐(gan)時耗(hao)(hao)用(yong)硫(liu)酸(suan)亞(ya)鐵(tie)銨溶液的(de)(de)體(ti)積(mL).
4. 計(ji)算(suan)
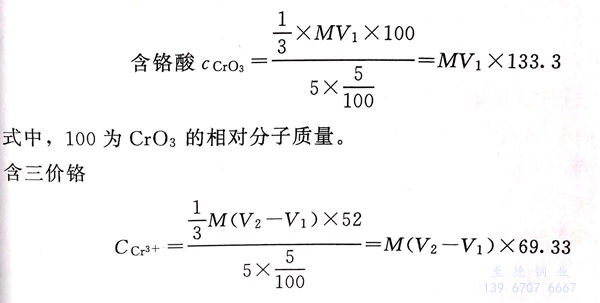
式中,52為Cr的(de)相對原(yuan)子(zi)質量。
注:如果鉻(ge)酐或(huo)三價鉻(ge)含量過(guo)高(gao),可適當減(jian)少(shao)電(dian)解液所(suo)取(qu)體積(ji)。



