當金屬與周圍介質接觸時,由于發生化學作用和電化學作用而引起的破壞叫金屬腐蝕(shi)。金屬腐蝕現象十分普遍,所造成的損失也很大。1981年對我國七個部門兩百多個工廠、企業進行的調查表明,因腐蝕造成的直接損失占各工廠、企業總產值的4%~5%,相當于基本建設的總投資。
金屬(shu)的腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi),按機理(li)不同和腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi)過程的特(te)點(dian),可(ke)分為(wei)物理(li)腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi)、化學(xue)腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi)與電化學(xue)腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi)。在工程實(shi)際應(ying)用中的金屬(shu)腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi),絕大(da)(da)多數都屬(shu)于(yu)化學(xue)腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi)和電化學(xue)腐(fu)(fu)(fu)蝕(shi)(shi)(shi)(shi)兩大(da)(da)類(lei)。
①. 化學腐蝕
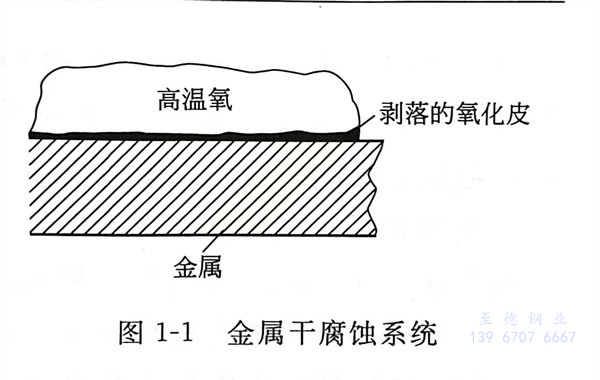
單純由化(hua)學作用引(yin)起(qi)的(de)(de)腐(fu)(fu)(fu)(fu)蝕(shi)(shi)叫做化(hua)學腐(fu)(fu)(fu)(fu)蝕(shi)(shi),化(hua)學腐(fu)(fu)(fu)(fu)蝕(shi)(shi)是沒(mei)有電流產生(sheng)的(de)(de)腐(fu)(fu)(fu)(fu)蝕(shi)(shi)過程。金屬(shu)在(zai)(zai)高溫(wen)下和干(gan)燥的(de)(de)氣體接觸,或在(zai)(zai)非電解質環境中,一般產生(sheng)化(hua)學腐(fu)(fu)(fu)(fu)蝕(shi)(shi)。例如(ru),在(zai)(zai)軋制(zhi)鋼(gang)筋(jin)的(de)(de)過程中,鋼(gang)筋(jin)表面的(de)(de)“鐵(tie)皮”就是鐵(tie)在(zai)(zai)高溫(wen)下被空氣氧(yang)(yang)化(hua)(腐(fu)(fu)(fu)(fu)蝕(shi)(shi))生(sheng)成的(de)(de)產物(見(jian)圖1-1)。由各種氧(yang)(yang)化(hua)物組成的(de)(de)鐵(tie)銹很疏松,沒(mei)有保護鋼(gang)鐵(tie)不再被腐(fu)(fu)(fu)(fu)蝕(shi)(shi)的(de)(de)能(neng)力。
金屬(shu)在(zai)非電解(jie)質(如苯、無水(shui)酒(jiu)精(jing)、石油等(deng))溶液中也會(hui)產生(sheng)化學腐蝕(shi)。例如,在(zai)石油中含有(you)(you)多種有(you)(you)機硫化物,它們對金屬(shu)輸油管及容器也會(hui)產生(sheng)化學腐蝕(shi)。
②. 電化學腐(fu)蝕
當金(jin)屬和(he)(he)電(dian)解質(zhi)溶(rong)液(ye)接(jie)觸(chu)時(shi),由(you)電(dian)化學(xue)(xue)作用(yong)引(yin)起的(de)腐蝕(shi)叫做電(dian)化學(xue)(xue)腐蝕(shi)。電(dian)化學(xue)(xue)腐蝕(shi)是有(you)電(dian)流產生的(de)腐蝕(shi)過程,它和(he)(he)化學(xue)(xue)腐蝕(shi)不同,這種腐蝕(shi)是由(you)于形(xing)成原電(dian)池(chi)(腐蝕(shi)電(dian)池(chi))引(yin)起的(de)。在(zai)這種腐蝕(shi)電(dian)池(chi)中(zhong),負極(ji)(ji)(ji)上進行氧化反(fan)應,通(tong)常(chang)叫做陽極(ji)(ji)(ji)(在(zai)討論腐蝕(shi)問(wen)題時(shi),通(tong)常(chang)稱(cheng)陰(yin)、陽極(ji)(ji)(ji),而不稱(cheng)正、負極(ji)(ji)(ji));正極(ji)(ji)(ji)上進行還原反(fan)應,通(tong)常(chang)叫做陰(yin)極(ji)(ji)(ji),參見圖1-2。
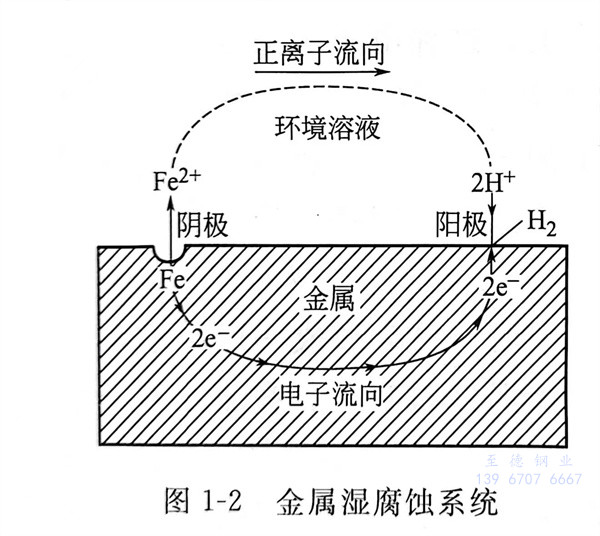
當鋼鐵暴露在潮濕的空氣中時,表面會形成一層極薄的水膜。空氣中的CO2、SO2等氣體溶解在水膜中,使其呈酸性。而通常的鋼鐵并非純金屬,常含有不活潑的合金成分(如Fe3C)或能導電的雜質。它們星羅棋布地鑲在鐵質的基體上,形成許多微小的腐蝕電池(微電池)。鐵為陽極,Fe3C或雜質為陰極。由于陰、陽極彼此緊密接觸,電化學腐蝕作用得以不斷進行。陽極的鐵被氧化成FFe2+進入水膜,同時電子移向陰極;H+在陰極(Fe3C或雜質)結合電子,被還原成氫氣析出。水膜中的Fe2+和由水離解出的OH-結合,生成Fe(OH)2。Fe(OH)2及其脫水產物Fe2O3是紅褐色鐵銹的主要成分。這種腐蝕過程中有氫氣析出,所以叫做析氫腐蝕。當介質的酸性較強時,鋼鐵發生析氫腐蝕。
當介質呈中性或酸性很弱時,則主要發生吸氧腐蝕。這是一種“吸收”氧氣的電化學腐蝕。此時,溶解在水膜中的氧氣是氧化劑。在陰極上,O2結合電子被還原成OH-;在陽極上,鐵被氧化成Fe2+。Fe2O3進一步被空氣中的O2氧化成Fe(OH)3,所得的產物與析氫腐蝕相似。由于O2的氧化能力比H+強,故在大氣中金屬的電化學腐蝕一般是以吸氧腐蝕為主。
金屬表面常因氧氣分布不均勻而引起腐蝕。例如,一段插入水中的鋼鐵支柱,接近水面的溶解氧的濃度較大(或分壓較大),而深入水中的溶解氧濃度較小(或分壓較小)。當氧的分壓(或濃度)愈大時,相應的電極電位代數值愈大,O2的氧化能力愈強。反之,則O2的氧化能力愈弱。這種腐蝕反應和吸氧腐蝕相同,只是發生的部位不同。這就說明浸入水中的鐵柱上的鐵銹雖然在近水面處,然而銹蝕卻發生在水下的一段上。這種由于氧濃度不同而造成的腐蝕,叫做濃差腐蝕(也稱作差異充氣腐蝕)。濃差腐蝕是金屬腐蝕中常見現象。如埋在地下的金屬管道的腐蝕、海水對船塢的“水線腐蝕”等。其中點腐蝕現象有它的特殊性,危害也較嚴重。
當一塊鋼板暴露在潮濕的空氣中時,總會形成一層Fe2O3薄膜。如果該膜是致密的,則可以阻滯腐蝕過程。若在膜上有一小孔,則有小面積的金屬裸露出來,這里的金屬將被腐蝕。腐蝕產物(Fe2O3、Fe3O4等)疏松地堆積在周圍,把孔遮住。這樣O2難于進入孔內,又會產生濃差腐蝕。同時孔內的H+濃度增加,使小孔內的腐蝕不斷加深,甚至穿孔。點腐蝕是一種局部腐蝕現象,常常被表面的塵土或銹堆隱蔽,不易發現,因而危害性更大。



