由圖9.2可以看出在不同條件下電化學腐蝕的四種(zhong)狀態:
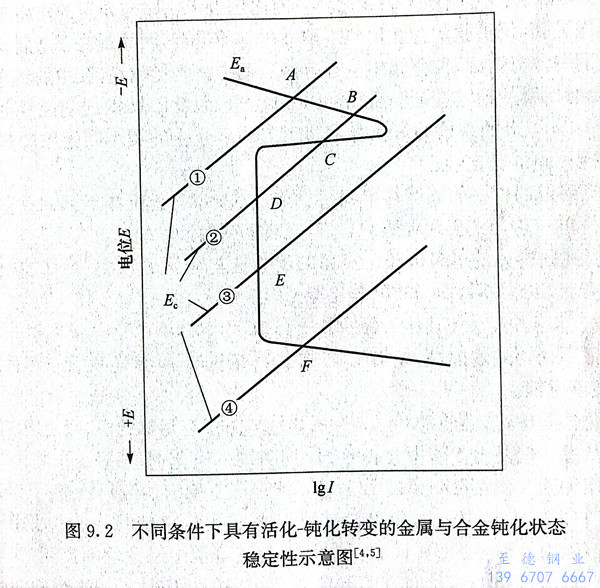
第一種狀態(圖9.2①)是(shi)陽極(ji)電(dian)位(wei)Ea和陰極(ji)電(dian)位(wei)E。僅有一個(ge)交點A,即僅有一個(ge)穩定(ding)態E。不超過初始鈍化電(dian)位(wei)Ep,此時金(jin)屬(shu)處于活化狀態,腐(fu)蝕電(dian)流強度(du)較大,因而腐(fu)蝕速率較大。鐵在稀硫酸中的腐(fu)蝕是(shi)一個(ge)典型的例子。
第二種狀態(圖9.2②)是Ea和E。有三個交點B、C、D,C點是不穩定的,B點和D點的狀態是相對穩定的,即金屬可以處于鈍化狀態,也可以處于活化狀態,這種鈍化狀態可以因為其他偶然因素而被破壞,從而使金屬或合金處于活化狀態,出現活化-鈍化頻繁交替的震蕩現象。18Cr-8Ni奧氏體不銹鋼(簡稱18-8不銹鋼)在含氧化劑的硫酸介質中即屬于這種情況。
第三種狀態(tai)(圖9.2③)是(shi)E。和E。交(jiao)于E點,只(zhi)有一(yi)個(ge)鈍(dun)化(hua)穩定電位(wei),這表明金(jin)屬或合金(jin)只(zhi)在鈍(dun)化(hua)狀態(tai)是(shi)穩定的,它能夠自動鈍(dun)化(hua),此時的腐蝕速率(lv)很(hen)小(xiao)。不(bu)銹(xiu)鋼(gang)在硝酸(suan)中便是(shi)這種情況。
第(di)四種狀(zhuang)態(tai)(圖9.2④)是E。和E。交(jiao)于(yu)F,處于(yu)過(guo)(guo)鈍化區,Er超過(guo)(guo)了過(guo)(guo)鈍化電位Er,金屬處于(yu)過(guo)(guo)鈍化狀(zhuang)態(tai),有較高的腐蝕(shi)速(su)率。鉻不(bu)銹鋼在濃縮硝(xiao)酸(suan)中就會產生(sheng)過(guo)(guo)鈍化。
不銹鋼只有在第(di)三種(zhong)狀態(tai),即(ji)處于鈍化狀態(tai),才是耐腐蝕的。



